Hidrojen bromür
| Hidrojen bromür | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kimlik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC adı | Hidrojen bromür | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K O AKA | 100.030.090 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 233-113-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüm | Sıkıştırılmış gaz, sıvılaştırılmış, renksiz, keskin kokulu. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kimyasal özellikler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kaba formül |
H Br [İzomerler] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar kütle | 80.912 ± 0.001 g / mol H% 1.25, Br% 98.75, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar moment | 0.8272 ± 0.0003 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziki ozellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° füzyon | 87 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kaynama | -67 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Çözünürlük | 20 ° C'de suda : 1930 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
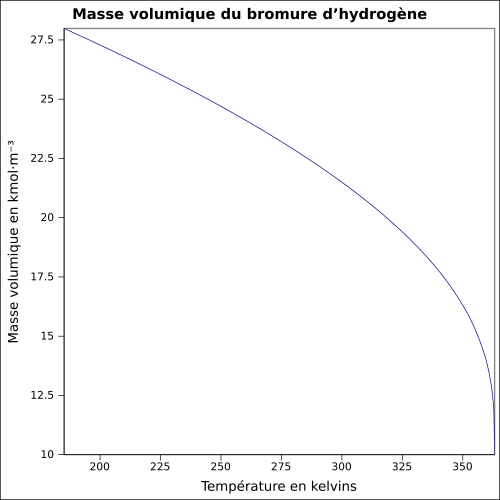
| Hacimsel kütle |
1,8 g · cm -3
denklem:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doygun buhar basıncı | de 20 ° C : 2,445 kPa
denklem:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritik nokta | 85,5 bar , 90,05 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ses hızı | 200 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokimya | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gaz, 1 bar | 198.7 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gaz | –36,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ buhar H ° | 12.69 kJ · mol -1 ( 1 atm , 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
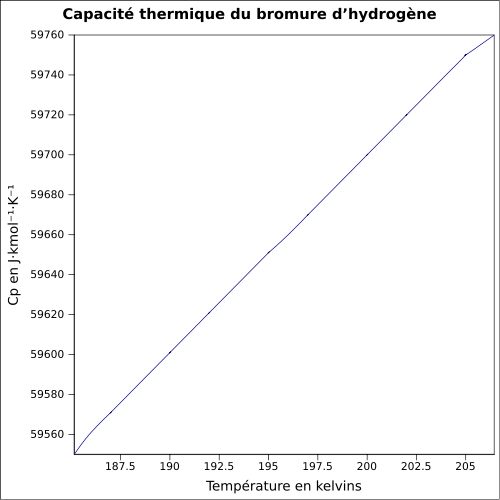
| C p | 29.1 J / mol K ( 25 ° C )
denklem:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Önlemler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Tehlike H314, H335, H314 : Ciddi cilt yanıklarına ve göz hasarına neden olur H335 : Solunum sistemini tahriş edebilir |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : 54.4 ° C'de sıkıştırılmış gaz mutlak basıncı = 4.130 kPa D1A : Ciddi ani etkileri olan çok toksik malzeme Tehlikeli malların taşınması: sınıf 2.3 E : Aşındırıcı malzeme Tehlikeli malların taşınması: sınıf 8 İçerik açıklama listesine göre% 1.0 açıklama |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ulaşım | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1048 : SUSUZ HİDROJEN BROMÜR |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soluma | toksik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cilt | Çok aşındırıcı | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gözler | Çok aşındırıcı | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksikoloji | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koku eşiği | düşük: 2 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aksi belirtilmedikçe SI ve STP birimleri . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
HBr kimyasal sembolü olan hidrojen bromür , nemle temas halinde beyaz dumanlar oluşturan, renksiz, toksik ve oldukça aşındırıcı bir gazdır . Bu dumanlar, hidrojen bromür suda çözüldüğünde oluşan hidrobromik asitten oluşur . Hidrojen bromür, kimya , endüstri veya laboratuvarlarda yaygın olarak kullanılan bir kimyasaldır . HBr adı bazen uygunsuz bir şekilde hidrojen bromür gazı yerine hidrobromik asidi ifade eder . Kimyagerler ayrıca hidrojen bromide atıfta bulunmak için gazlı veya susuz hidrobromik asitten bahseder.
Tarih
Hidrojen bromür, Montpellier yakınlarındaki tuz bataklıklarında brom keşfi sırasında kimyager Antoine-Jérôme Balard tarafından incelendi ve hazırlandı .
Kimya
Hidrojen bromür molekülü HBr, tek bir kovalent bağ ile bağlanan bir hidrojen atomu H ve bir bromin atomu Br'den oluşan iki atomlu bir moleküldür . Brom hidrojenden daha elektronegatif olduğu için bağ polarize olur . Sonuç olarak molekül , brom atomu tarafından taşınan negatif kısmi yük δ- ve hidrojen atomu tarafından taşınan pozitif kısmi yük δ + ile bir dipol momenti taşır . Hidrojen bromür bu nedenle polar bir moleküldür ve suda ve polar çözücüler içinde çok çözünür. Hidrobromik asit çözeltileri, ağırlıkça% 68.85 HBr ile doyurulur. Oda sıcaklığında, hidrojen bromür, hidrobromik asit oluşumu nedeniyle nemli havada sigara içen keskin kokulu bir gazdır.
Endüstriyel üretim
Hidrojen bromür, kimya endüstrisinin ana ürünleri olan hidrojen klorür ve hidroklorik aside kıyasla endüstriyel olarak küçük miktarlarda üretilir . HBr'nin en yaygın preparasyonu, dihidrojen ve bromu yüksek sıcaklıkta ( 200 ila 400 ° C ) karıştırmaktır. Reaksiyon genellikle platin ile katalize edilir .
Hidrojen bromür sentezi
HBr'nin hazırlanması birçok yöntem kullanılarak yapılır.
Bir çok basit bir sentezi arasındaki reaksiyonu kullanan sülfürik asit ve sodyum bromür :
NaBr (k) + H 2 SO 4 (sulu) → NaHSO 4 (k) + HBr (g)Bununla birlikte, bu sentez iyi bir verime sahip değildir çünkü oluşan hidrojen bromür, sülfürik asit tarafından dibromaya oksitlenir :
2HBr (g) + H 2 SO 4 (aq) → Br 2 (g) + SO 2 (g) + 2H 2 O (l)Bu yöntem için asetik asit veya fosforik asit gibi oksitleyici olmayan asitler kullanılabilir.
İndirgenmesi dibroma ile fosfor asidi ya da kükürt dioksit da HBr elde edilmesini mümkün kılar:
Br 2 + H 3 PO 3 + HO - → H 2 PO 4 - (k) + 2HBr (g) Br 2 + SO 2 + 2H 2 O → H 2 SO 4 + 2HBr (g)Son olarak, metal bromürlerin hidrolizi, basit bir şekilde ıslak olan ve reaksiyonda iyi bir verimle yer alan kalıntı cisimlerle kirlenen hidrojen bromürün oluşturulmasını mümkün kılar. Bu, yaygın olarak kullanılan bir işlemdir.
Hidrojen bromür her zaman bromlu su buharlarına neden olur. Bunlar, küçük cam tüp parçalarıyla geçirgen hale getirilen bir kırmızı fosfor ve su veya hidrobromik asit macunu ile çıkarılır. Kuru ve bromsuz gaz artık kauçuğa saldırmaz.
Kullanımlar
Hidrojen bromürün organik ürünlerin sentezinde birçok kullanımı vardır .
Örneğin, alkollerden alkil bromür üretmek için kullanılır:
ROH + HBr → R + OH 2 + Br - → RBr + H 2 OBromoalkanları vermek için alkenlere eklenir:
RCH = CH 2 + HBr → RCH (Br) –CH 3Bromoalken oluşturmak için alkinlere eklenir. Stereokimya ek bu tip anti geçerli:
RC≡CH + HBr → RCH (Br) = CH 2Bir geminal dihaloalkan oluşturmak için haloalkenlere eklenir . Bu tür bir ekleme Markovnikov kuralını izler :
RC (Br) = CH 2 + HBr → RC (Br 2 ) –CH 3Ayrıca hidrojen bromür, epoksitleri ve laktonları açmak için ve ayrıca bromoasetallerin sentezinde kullanılır. Ve son olarak, hidrojen bromür birçok organik reaksiyon için bir katalizördür .
güvenlik
Hidrojen bromür, nem varlığında çoğu metalle reaksiyona girerek çok yanıcı bir gaz olan hidrojeni oluşturur . Bazlarla reaksiyon çok şiddetli olabilir. Ayrıca oluşturmak üzere su ile reaksiyona girer hidrobromik asit , bir kuvvetli asit . Suyun pH'ında değişikliğe neden olduğu için bu ürün çevreye salınmamalıdır. Su ile karıştırıldığında hızlı korozyona neden olur . Hidrojen bromür havadan daha ağır bir gazdır ve yer altında veya dar alanlarda birikebilir. Nemli bir atmosferde beyaz buharlar açığa çıkar.
Dış bağlantılar
Eksiksiz güvenlik veri sayfası
Ayrıca görün
Referanslar
- HYDROGEN BROMIDE , Uluslararası Kimyasal Güvenlik Programının güvenlik sayfaları , 9 Mayıs 2009 tarihinde başvurulmuştur.
- (inç) David R. Lide, Kimya ve Fizik El Kitabı , Boca Raton, CRC,16 Haziran 2008, 89 inci baskı. , 2736 s. ( ISBN 978-1-4200-6679-1 ve 1-4200-6679-X ) , s. 9-50
- hesaplanan moleküler kütlesi " Elements 2007 Atom ağırlıkları " üzerine www.chem.qmul.ac.uk .
- (en) Robert H. Perry ve Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 inci baskı. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- " Properties of Various Gases " , flexwareinc.com ( 12 Nisan 2010'da erişildi )
- (in) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 978-1-4398-2077-3 ) , s. 14-40
- (in) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 inci baskı. , 2804 s. , Ciltli ( ISBN 978-1-4200-9084-0 )
- 1272/2008 sayılı AT yönetmeliği Ek VI tablo 3.1'deki endeks numarası (16 Aralık 2008)
- " Hidrojen bromür kimyasal ürünlerin veritabanındaki" Reptox ait CSST 23 Nisan 2009 erişilen (iş güvenliği ve sağlığı sorumlu Quebec örgütü),
- " hidrojen bromür " de hazmap.nlm.nih.gov (erişilen Kasım 14, 2009 )