Hidrojen klorür
| Hidrojen klorür | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kimlik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC adı |
hidroklorik asit hidrojen klorür |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K O AKA | 100.028.723 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-595-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüm | keskin bir koku ile renksiz gaz. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kimyasal özellikler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kaba formül |
H Cl [İzomerler] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar kütle | 36.461 ± 0.002 g / mol H% 2.76, Cl% 97.23, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar moment | 1.1086 ± 0.0003 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziki ozellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° füzyon | -114 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kaynama | en 101.3 kPa : -85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Çözünürlük | 20 ° C'de suda : 720 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hacimsel kütle |
1.00045 g · l -1 (gaz)
denklem:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doygun buhar basıncı |
denklem:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritik nokta | 51.35 ° C , 8.26 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Üçlü nokta | 160 K ( -114 ° C ), 13,8 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ses hızı | 296 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokimya | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gaz, 1 bar | 186,90 J · K -1 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gaz | -92,31 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ buhar H ° |
16.15 kJ - mol- 1 ( 1 atm , -85 ° C ); 9,08 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p | 29,14 J / mol K ( 25 ° C )
denklem:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Önlemler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Tehlike H314, H331, H314 : Ciddi cilt yanıklarına ve göz hasarına neden olur H331 : Solunması halinde toksiktir |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Sıkıştırılmış gaz 50 ° C'de mutlak buhar basıncı = 7,950 kPa D1A : Ciddi ani etkilere sahip çok toksik malzeme Tehlikeli malların taşınması: sınıf 2.3 E : Aşındırıcı malzeme Tehlikeli malların taşınması: sınıf 8 İçerik açıklamasına göre% 1,0 oranında açıklama liste |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 1 W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ulaşım | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
268 : zehirli ve aşındırıcı gaz UN numarası : 1050 : SUSUZ HİDROJEN KLORÜR Sınıf: 2.3 Sınıflandırma kodu: 2TC : Sıvılaştırılmış gaz, toksik, aşındırıcı; Etiketler: 2.3 : Zehirli gazlar (büyük T ile gösterilen gruplara karşılık gelir, yani T, TF, TC, TO, TFC ve TOC). 8 : Aşındırıcı maddeler  
2186 : HİDROJEN KLORÜR, SOĞUTULMUŞ SIVI Sınıf: 2.3 Sınıflandırma kodu: 3TC : Soğutulmuş sıvılaştırılmış gaz, toksik, aşındırıcı; Etiketler: 2.3 : Zehirli gazlar (büyük T ile gösterilen gruplara karşılık gelir, yani T, TF, TC, TO, TFC ve TOC). 8 : Aşındırıcı maddeler   Bölüm 2.2.2.2.2'ye göre, soğutulmuş sıvılaştırılmış haldeki hidrojen klorürün ADR " ADR 2021 Cilt 1 " [PDF] , Birleşmiş Milletler,2020( ISBN 978-92-1-139177-0 istişare, 04/30/21 ) , s. 136 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soluma | temiz havaya getirin, muhtemelen kardiyopulmoner resüsitasyon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cilt | kirli kıyafetleri çıkarın, bol su ile yıkayın, bir doktora görünün | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gözler | göz kapaklarını açık tutarak bol su ile yıkayın, bir göz doktoruna görünün | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yutma | içmeyin, kusturmaya çalışmayın, bir doktora başvurun. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksikoloji | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koku eşiği | düşük: 0,25 ppm yüksek: 10,06 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aksi belirtilmedikçe SI ve STP birimleri . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hidrojen klorür , kimyasal simgesi H Cı , a, meydana gelen vücut arasında klor ve hidrojen , renksiz, toksik ve yüksek aşındırıcı . Altında sıcaklık ve basınç çevre koşulları , bir bir gaz ile temas halinde beyaz dumanlar oluşturan nem . Bu dumanlar , sudaki iyonik bir hidrojen klorür çözeltisi olan hidroklorik asitten oluşur .
Hidroklorik asit gibi hidrojen klorür kimyada , endüstride veya bilimde önemli bir kimyasaldır . HCl adı bazen uygunsuz bir şekilde saf hidrojen klorür yerine hidroklorik asidi ifade eder . Kimyagerler bazen hidrojen klorüre atıfta bulunmak için gazlı veya susuz hidroklorik asitten bahseder.
Tarih
Hidrojen klorür beri bilinmektedir Orta Çağ zaman, Simyacıların biliyorlardı hidroklorik asit (o olarak bilinen tuz ruhu veya Limon tuzu salis ) adı buharlar ile ilgili bazı durumlarda olduğu deniz asit gazı .
İçin XVII inci yüzyıl , Johann Rudolf Glauber tuzu (kullanılan sodyum klorid ) ve sülfürik asit üretmek için , sodyum sülfat , ikincil reaksiyon ürünü, hidrojen klorür ile,:
2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4.Bu keşif bazen 1772'de de bu reaksiyonu gerçekleştiren Carl Wilhelm Scheele'ye atfedilir. Joseph Priestley 1772'de saf hidrojen klorür elde etti ve 1818'de Humphry Davy bu gazın hidrojen ve klordan oluştuğunu gösterdi .
Sanayi devrimi sırasında, alkali maddelere ve özellikle sodyum karbonata olan talep gittikçe daha önemli hale geldi. Nicolas Leblanc , sodyum karbonat üretimi için yeni bir endüstriyel proses geliştirdi . Gelen Leblanc işlemi , tuz ( sodyum klorür ) dönüştürülür sodyum karbonata kullanılarak sülfürik asit , tebeşir ve kömür hidrojen klorür ikincil üretimi ile. İçinde yürürlüğe girmesi kadar İngiltere'de ait Alkali Yasası 1863 yılında, ikincisi havaya serbest bırakıldı. Sodyum karbonat üreticileri daha sonra onu suda çözmek zorunda kaldı ve bu da endüstriyel ölçekte hidroklorik asit üretmeyi mümkün kıldı . Daha sonra, Hargreaves prosesi benzer geliştirilmiştir Leblanc işlemi dışında sülfürik asit ile değiştirilir , kükürt dioksit , su ve hava . Başında XX inci yüzyılda , Leblanc işlemi ile değiştirildi Solvay işlemi hidrojen klorid üretmez. Bununla birlikte, hidrojen klorür, hidroklorik asit üretiminde hala bir adımdır .
Kimya
Molekül HCI hidrojen klorür, aşağıdakilerden oluşan bir iki atomlu molekül atomu arasında hidrojen , H ve bir atomu klor , bir ile bağlanmış Cl, tek bir bağ . Klor hidrojenden çok daha elektronegatif olduğu için bağ polarize olur. Bunun bir sonucu olarak, molekül, bir taşır büyük dipol momentine a, negatif kısmi yük ö - klor atomu ve bir pozitif kısmi şarj δ taşıdığı + hidrojen atomu taşıdığı. Hidrojen klorür bu nedenle polar bir moleküldür . Çok olan çözünür olarak su ve polar solventlerin .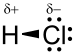
Su ile temas halinde, hidrojen klorür iyonize oluşturmak üzere Cl - klorid anyonları ve hidronyum H 3 O + katyonları (H + solvatlanmış ):
HCl + H 2 O → H 3 O + + Cl -Reaksiyondan ortaya çıkan çözelti hidroklorik asit olarak adlandırılır . Bu bir kuvvetli asit olan bu araçlar asitlik sabiti K , bir su içinde hidrojen klorür ayırdığını neredeyse tamamen: (HCI molekülün ayrışma hızı ile ilişkilidir) oldukça yüksektir.
Suyun yokluğunda bile, hidrojen klorür hala bir asit gibi davranır . Örneğin, HCl metanol ve protonat iyonları veya molekülleri gibi diğer çözücülerde çözünerek susuz koşulların (tamamen yokluğu) gerekli olduğu belirli kimyasal reaksiyonlar için bir katalizör asit görevi görebilir:
HCl + CH 3 OH → CH 3 O + H 2 + Cl -(Bir metanol molekülü CH HCI ile protonlanması 3 OH)Hidrojen klorür asidik yapısı nedeniyle , özellikle nem varlığında ( 2 - 5 ppm su yeterlidir) aşındırıcı bir gazdır .
Üretim
Endüstride üretilen hidrojen klorürün çoğu hidroklorik asit üretiminde kullanılmaktadır .
Endüstride hidrojen klorür üretmenin yaygın bir yöntemi, dihidrojen ve gaz halindeki klorun hidrojen klorür oluşturmak üzere ekzotermik bir reaksiyonda reaksiyona girdiği "HCl fırını" dır :
Cl 2 + H 2 → 2 HClBu reaksiyon, özellikle gıda endüstrisi için amaçlanan çok saf bir ürün üretmek için kullanılır.
Hidrojen klorür ayrıca klordan ve hidrojen içeren bileşiklerden, örneğin hidrokarbonlardan da üretilebilir . Organik bileşiklerin klorlanması, hidrojen klorür üretimine yol açabilir:
RH + Cl 2 → R-Cl + HClFlorlu bileşikler oluşturmak için klorlu ürünlerin hidrojen florür ile reaksiyona sokulması da hidrojen klorür üretir:
R-Cl + HF → RF + HClBu reaksiyonlar susuz ortamda (susuz) gerçekleştiğinde, gaz halinde HCl oluşur.
Hidrojen klorür ayrıca sodyum klorür (NaCl) ve sülfürik asitten endüstriyel ölçekte üretilebilir :
2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4 .
Hidrojen klorür sentezi
Hidrojen klorür, fosfor klorür , tiyonil klorür (SOCl 2 ) veya asil klorürler gibi bazı klorlanmış fazla reaktiflere yavaşça su (veya asit ) ilave edilerek sentezlenebilir . Çok fazla su eklemek, oluşan hidrojen klorürün çözünmesine ve hidroklorik asit oluşumuna yol açabilir . Örneğin, soğuk suyun fosfor pentaklorüre yavaş eklenmesi , aşağıdaki HCI oluşumuna yol açar:
PCl 5 + H 2 O → POCl 3 + 2 HClSıcak su eklemek mümkün daha HCl elde edilmesini mümkün kılar hidrolize PCL 5 için fosforik asit . Su ve PCl 3 fosfor triklorür arasındaki kimyasal reaksiyon da HCl üretir.
Reaksiyon tionil klorür , su ile HCI olarak üreten kükürt dioksit SO 2 . Tiyonil klorür veya asil klorürlerin su ile reaksiyonları için, bkz. Tionil klorür ve asil klorür .
HCl üreteci
Farklı yöntemlere göre bir HCl jeneratörü kullanılarak laboratuvarda kullanılmak üzere küçük miktarlarda HCl hazırlamak mümkündür :
- konsantre sülfürik asit kullanılarak konsantre hidroklorik asitten salım .
- susuz kalsiyum klorür kullanılarak konsantre hidroklorik asitten salım .
- aşağıdaki sülfürik asit ve sodyum klorürü reaksiyona sokarak : NaCl + H 2 SO 4 → NaHSO 4 + HCl ↑
Genellikle hidroklorik asit veya sülfürik asit, bir şişe içindeki reaktife damla damla eklenir. HCl, konsantre sülfürik asit içinden köpürtülerek kurutulabilir.
Kullanımlar
Boyunca hidrojen klorür tarihi kullanım XX inci yüzyılın içerir hidroklorinasyon ait alkinler üretimi için monomer klorlanmış kloropren ve vinil klorür daha sonra edilir, polimerize polikloropren (yapmak neopren ) ve polivinil klorür (PVC). Vinil klorür üretimi için, asetilen (Cı- 2 , H 2 ) şekli, vinil klorür üçlü bağa HCI ilave maruz kalır.
1960'lardan beri kloropren üretmek için kullanılan "asetilen işlemi", iki asetilen molekülünün reaksiyonuyla başlar . Elde edilen ara ürün, kloroprene yol açan üçlü bağ üzerine bir HCl ilavesinden geçer:

Asetilen işlemi Cı hangi bir yöntem ile ikame edilmiş 2 1,3-çift bağların biriyle ekler bütadien kloropren ve HCl üreten çıkarılması, ardından.
Şu anda, hidrojen klorürün ana uygulamaları şunlardır:
- çoğunlukla hidroklorik asit üretimi
- kauçuğun hidro klorlanması
- Üretim vinil klorür ve alkil klorid
- pamuk işleme
- yarı iletken endüstrisi .
Sağlık etkileri

Hidrojen klorür , vücut dokuları ile temas ettiğinde hidroklorik asit oluşturur . Solunması öksürük, boğulma, burun duvarlarında, boğazda ve solunum sisteminde iltihaplanmaya neden olabilir. En ağır vakalarda akciğer ödemine , kardiyovasküler sistem yetmezliğine ve ölüme neden olabilir. Hidrojen klorür, ciddi göz yanıklarına ve geri dönüşü olmayan göz hasarına neden olabilir. Yalnızca iyi havalandırılan bir odada ve bir maske ile kullanılmalıdır.
Ayrıca görün
Notlar ve referanslar
- HYDROGEN CHLORIDE , Uluslararası Kimyasal Güvenlik Programının güvenlik sayfaları , 9 Mayıs 2009 tarihinde başvurulmuştur.
- (inç) David R. Lide, Kimya ve Fizik El Kitabı , Boca Raton, CRC,16 Haziran 2008, 89 inci baskı. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 9-50
- hesaplanan moleküler kütlesi " Elements 2007 Atom ağırlıkları " üzerine www.chem.qmul.ac.uk .
- (en) Robert H. Perry ve Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 inci baskı. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- (in) Klotz, Irving M. / Rosenberg, Robert M., Chemical Thermodynamics, Basic Concepts and Methods , Wiley-VCH Verlag GmbH & Co. KGaA,2008, 564 s. ( ISBN 978-0-471-78015-1 ve 0-471-78015-4 ) , s. 98
- (in) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 978-1-4398-2077-3 ) , s. 14-40
- (in) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 inci baskı. , 2804 s. , Ciltli ( ISBN 978-1-4200-9084-0 )
- ESIS'de "Hydrogen chloride" , 19 Şubat 2009'da erişildi
- 1272/2008 sayılı AT yönetmeliği Ek VI tablo 3.1'deki dizin numarası (16 Aralık 2008)
- " Hidrojen klorür kimyasal ürünlerin veritabanındaki" Reptox ait CSST 25 Nisan 2009 erişilen (iş güvenliği ve sağlığı sorumlu Quebec örgütü),
- " Hydrogen chloride " , hazmap.nlm.nih.gov (erişim tarihi 14 Kasım 2009 )
- " Hidrojen klorür " , üzerinde Fransa'nın Chemical Company ,Temmuz 4, 2016( 4 Temmuz 2016'da erişildi )







