Kimotripsin
Kimotripsin bir olan peptidaz tarafından salgılanan sindirim pankreas ailesinin, serin proteazlar , katalize proteolizi . Bu bir kodlanmış iki tarafından gen yer alan kromozom 16 , ürün olup, burada bir bir proenzim olarak adlandırılan kimotripsinojen kendini kimotripsin vermek üzere, daha sonra aktive edilmelidir. Bu enzim, tercihen hidrolize proteinler seviyesinde peptid bağları bir alt baş tortu bir tirozin arasında, triptofan bölgesinin fenilalanin arasında, metionin ya da lösin . Aktif saha kimotripsinin sahip hidrofobik cep içinde amino asit arasında alt-tabaka yer almaktadır . Bu, bağın konumlandırılmasının katalitik serinin karşısında bölünmesine izin verir.
Kimotripsin| EC No. | EC |
|---|---|
| CAS numarası |
| IUBMB | IUBMB girişi |
|---|---|
| IntEnz | IntEnz görünümü |
| BRENDA | BRENDA girişi |
| KEGG | KEGG girişi |
| MetaCyc | Metabolik yol |
| PRIAM | Profil |
| PDB | Yapılar |
| GİT | AmiGO / EGO |
Sentez ve aktivasyon
Kimotripsin, kimotripsinojen adı verilen inaktif bir formda pankreas tarafından üretilir . Aktivasyona, bu molekülü iki zincire bölen tripsin , daha sonra trans -proteoliz sırasında kimotripsin , sonunda iki disülfür köprüsü ile bağlanan ve 120 amino asitlik 2 etki alanına katlanmış üç zincirin kompakt küresel yapısını verir.
Bu alanlar, 6 β şeritten oluşan bir namlunun konformasyonunu benimser.
Aktif bölge, 2 alan tarafından sınırlanan bir yarıkta yer almaktadır. Substratı 2 bölge seviyesinde bağlar (bölge 214-216, spesifik olmayan bağlama ve bölge 189-216 ve 226, spesifik bağlama).
Eylem mekanizması
Kimotripsin katılır proteoliz ait proteinler içinde sindirim sistemi arasında memeliler ve diğer canlılarla. Polipeptit zincirlerinin hidroliz yoluyla bölünmesini katalize eder , bu mekanizma başlangıçta bir aktivatör olmadan aşırı derecede yavaştır.
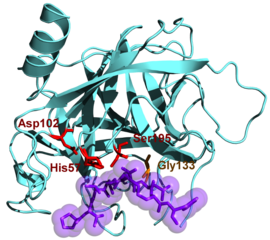
Kimotripsin , bir kovalent substrat-enzim ara maddesi oluşturmak için substratına bağlanan serin 195 yoluyla bir peptit bağında yer alan potansiyel olarak nükleofilik karbonil gruplarına saldırır . Enzimin aktif bölgesi ayrıca His57, Asp102 ve Gly193 amino asitlerini içerir.
Kimotripsin substratıyla reaksiyonunun iki fazda meydana geldiği gösterilmiştir: reaksiyonun en başında bir ilk patlama fazı, ardından Michaelis-Menten yasasını izleyen bir sabit durum fazı .
Kimotripsin enzimatik aktiviteyi sürdürmek için kesinlikle soğuk tutulmalıdır.
-
Kimotripsin etki mekanizması.
Sıra
Sekans kimotripsinojen B1 (genler 16q23 ve 16q24.1)
10 20 30 40 50 60 MASLWLLSCF SLVGAAFGCG VPAIHPVLSG LSRIVNGEDA VPGSWPWQVS LQDKTGFHFC 70 80 90 100 110 120 GGSLISEDWV VTAAHCGVRT SDVVVAGEFD QGSDEENIQV LKIAKVFKNP KFSILTVNND 130 140 150 160 170 180 ITLLKLATPA RFSQTVSAVC LPSADDDFPA GTLCATTGWG KTKYNANKTP DKLQQAALPL 190 200 210 220 230 240 LSNAECKKSW GRRITDVMIC AGASGVSSCM GDSGGPLVCQ KDGAWTLVGI VSWGSDTCST 250 260 SSPGVYARVT KLIPWVQKIL AANSekans kimotripsinojen B2 (gen 16q23.1)
10 20 30 40 50 60 MAFLWLLSCW ALLGTTFGCG VPAIHPVLSG LSRIVNGEDA VPGSWPWQVS LQDKTGFHFC 70 80 90 100 110 120 GGSLISEDWV VTAAHCGVRT SDVVVAGEFD QGSDEENIQV LKIAKVFKNP KFSILTVNND 130 140 150 160 170 180 ITLLKLATPA RFSQTVSAVC LPSADDDFPA GTLCATTGWG KTKYNANKTP DKLQQAALPL 190 200 210 220 230 240 LSNAECKKSW GRRITDVMIC AGASGVSSCM GDSGGPLVCQ KDGAWTLVGI VSWGSRTCST 250 260 TTPAVYARVA KLIPWVQKIL AANNotlar ve referanslar
- kütle değerleri ve kalıntıların sayısı burada belirtilen olanlardır protein öncüsünün elde edilen çeviri bölgesinin gen önce, post-translasyonel modifikasyonlar , ve karşılık gelen değerlerden önemli ölçüde farklı olabilir için işlevsel protein .