Lizozim
Lizozim veya muramidaz a, proteinin , uzun yüz Küresel amino asitleri bakteriyel enfeksiyonlara karşı savunma katılır (insanda 130). Birçok hayvan türünde (omurgalılar, böcekler, akarlar ve bazı yumuşakçalar) bulunur. Özellikle bir takım salgılarda ( gözyaşı , tükürük , anne sütü , mukus ...) ve yumurta akında (tavuklarda 129 amino asit) bulunur.
Bir olan asidik glikosid hidrolaz ( AT tarafından salgılanan 3.2.1.17) granülosit ve monositler . Bu yok bakteriyel duvarı arasında Gram-pozitif bakteri katalizlerler hidroliz ait peptidoglikanlara devam etmesidir. Bu özellik, bazı yazarları Onu bedensel bir antibiyotik olarak nitelendirmeye sevk etti . Daha doğrusu lizozim, doğuştan gelen bağışıklığın bileşenlerinden biridir .
Bu protein, 1922'de Alexander Fleming tarafından keşfedildi .
Yumurta beyazı lizozim (tip-C), tatlandırıcı protein thaumatininkinden ( algılama eşiğinde ) 200 kat daha yoğun tatlı bir tada sahiptir .
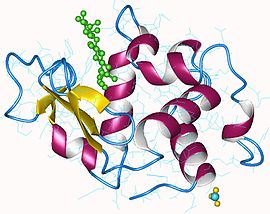
Lizozim Tavuk yumurtası lizoziminin tersiyer yapısı ( PDB 132l )
Tavuk yumurtası lizoziminin tersiyer yapısı ( PDB 132l )
| EC No. | EC |
|---|---|
| CAS numarası |
| IUBMB | IUBMB girişi |
|---|---|
| IntEnz | IntEnz görünümü |
| BRENDA | BRENDA girişi |
| KEGG | KEGG girişi |
| MetaCyc | Metabolik yol |
| PRIAM | Profil |
| PDB | Yapılar |
| GİT | AmiGO / EGO |
 Bobwhite bıldırcın lizozimi ( PDB 1DKJ )
Bobwhite bıldırcın lizozimi ( PDB 1DKJ )
| Pfam | PF00062 |
|---|---|
| Klan Pfam | CL0037 |
| InterPro | IPR001916 |
| PROSİTE | PDOC00716 |
| KAPSAM | 1e0g |
| SÜPER AİLE | 1e0g |
| TCDB | 9.B.41 |
| CAZy | GH22 |
| CDD | cd00119 |
Aksiyon modu
Lizozim, doğuştan gelen bir opsonin olarak veya bakterileri, özellikle de Gram-pozitif bakterileri, patojeniteleri ne olursa olsun parçalayabilen bir litik enzim olarak hareket edebilir . Öte yandan, Gram negatif bakteriler, onları karakterize eden lipopolisakkaritlerin (LPS) dış tabakası sayesinde genellikle bu enzime dirençlidir. Bu LPS tabakası, mureik duvarı (örneğin, bir peptidoglikan tabakası) örter ve bu enzime erişimini engelleyerek onu lizozimin saldırısına karşı korur.
Lizozim ve böylece bir negatif yük azaltılması ve kolaylaştırıcı, bakteriyel yüzeye takılarak bir doğuştan gelen spesifik olmayan opsonin olarak işlev görür fagositoz sistemi satın içinde opsoninlerin önce bakterilerin bağışıklık . Başka bir deyişle lizozim, lökositler tarafından fagositozu kolaylaştırır .
Bakteriyel parçalanma ile ilgili olarak, enzim, bakteri duvarını oluşturan peptidoglikanlara (özellikle Gram pozitif bakterilere ) saldırır . Arasında Gerçekten de, lizozim hidroliz kovalent bağlar (β1 → 4 glikosidik bağı) N-asetil-muramik ve 4 inci karbon atomu N-asetil-glukozamin . Peptidoglikan molekülü, iki alan arasındaki bir girintide bulunan enzimin bağlanma sahası ( Bağlanma Yeri ) ile ilişkilidir . Bu, substrat molekülünü geçiş durumunun konformasyonunu benimsemeye zorlar. Amino asitleri Glu 35 ( glutamik asit, amino asit numarası 35), ve Asp 52 ( aspartik asit, bir amino asit numarası 52) enzimatik aktivitesi için esas olduğu gösterilmiştir. Glu 35 , glikosidik köprüde bir proton donörü olarak görev yapar ve substratın CO bağını keser, Asp 52 ise glikosile edilmiş bir enzimin geçici oluşumuna izin veren bir nükleofil görevi görür . Bu daha sonra bir su molekülü ile reaksiyona girerek hidrolizin son ürününü ve enzimi orijinal biçiminde verir.
Lizozime bağlı hastalıklar
Lizozim genindeki bir mutasyon , belirli dokularda amiloid proteinlerinin birikmesine neden olabilir .
Teşhis amaçlı kullanım
Kandaki artan lizozim seviyesi genellikle sarkoidoz ile bağlantılıdır . Değerleri 8 mg / L veya daha fazla kabul edilir en yüksek.
Referanslar
- (en) Bay Muraki, K. Harata, N. Sugita ve K. Sato , " Man K1,4-GlcNAc'nin 2 ', 3'-Epoksipropil-p-glikositi ile Etiketlenmiş İnsan Lizoziminin X-ışını Yapısı. Yapısal Değişim ve alt site ile tanıma Özgünlük B ” , Açta Crystallographica Section D - Structural Biology , vol. 54, n o Pt 1, Eylül 1998, s. 834-843 ( PMID 9757098 , DOI 10.1107 / S090744499800122X , çevrimiçi okuyun )
- kütle değerleri ve kalıntıların sayısı burada belirtilen olanlardır protein öncüsünün elde edilen çeviri bölgesinin gen önce, post-translasyonel modifikasyonlar , ve karşılık gelen değerlerden önemli ölçüde farklı olabilir için işlevsel protein .
- Lenka Grunclov, Hélène Fouquier, Václav Hyps ve Petr Kopásek, Yumuşak kene Ornithodoros moubata'nın bağırsaklarından Lysozyme: sekans, filogeni ve beslenme sonrası düzenleme ; Developmental & Comparative Immunology Cilt 27, Sayı 8, Eylül 2003, Sayfalar 651-660 doi: 10.1016 / S0145-305X (03) 00052-1 ( Özet )
- (en) Masuda, T. & Kitabatake, Tatlı proteinlerin biyoteknolojik üretimindeki gelişmeler. J. Biosci. Bioeng. 2006, 102, 375–389